生物化学与分子生物学/纤维蛋白原转变为纤维蛋白

图10-8 纤维素蛋白原分子示意图
上半为电镜下的分子形状 下半示6条多肽链,
一为双硫键,▲为凝血酶作用点
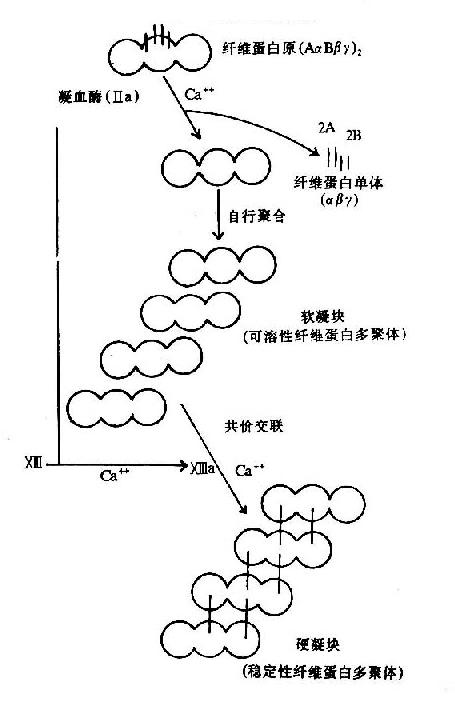
图10-9 纤维素蛋白凝胶的生成
血液凝固的实质是纤维蛋白凝胶的生成,它是血浆中纤维蛋白原(fibrinogen)在凝血酶作用下降解为纤维蛋白并聚合成不溶性的网状结构。
纤维蛋白原分子由两对α链、β-链及γ-链组成,每3条肽链(α、β、γ)绞合成索状,形成两条索状肽链,在N末端有二硫键使态个分子得到稳定。α及β肽链的N-端分别有一段16个及14个氨基酸的小肽,称为纤维肽A及B。因此,纤维蛋白原可写为(AαBβγ)2(图10-8)。
凝血酶的本质为一种蛋白水解酶,能特异性作用于Aα和Bβ链上的精-甘肽键。切除A、B纤维肽。因纤维肽A及B均为酸性肽,带较多负电荷。由于电荷排斥作用阻碍纤维蛋白原之间聚合。切除纤维肽A及B转变为纤维蛋白后负性减小,同时暴露了互补结合位点,有利于自动聚合,纤维蛋白单位通过边靠边、端靠端的聚合形成聚合链。此种多聚体不稳定,称为软凝块(soft clot)。它再通过因子XⅢa的作用结成牢固的网。因子XⅢa为转肽酶,能催化一个单体的谷氨酸残基的γ-羧基与另一单体的赖氨酸残基的氨基之间形成共价结合,其间释出NH3(图10-9,10)。因此,因子XⅢa称为纤维蛋白稳定因子(fibrin stabilizingfactor,FSF)。因子XⅢ存在于血小板及血浆中,经凝血酶切除部分肽段后被激活为XⅢa。
由此产生的稳定纤维蛋白网与软凝块不同,它们在5M的脲及1%氯乙酸溶液中不溶解。在血小板的血栓收缩蛋白作用下,此网状结构收缩,于是伤口边缘彼此靠近,易于伤口闭合。成纤维细胞的表面带有一种类似纤维蛋白的蛋白质,称粘连蛋白,它由Ⅻa催化与纤维蛋白结成网。并将纤维蛋白固定下来。所以,因子Ⅻa还直接参与伤口的愈合。
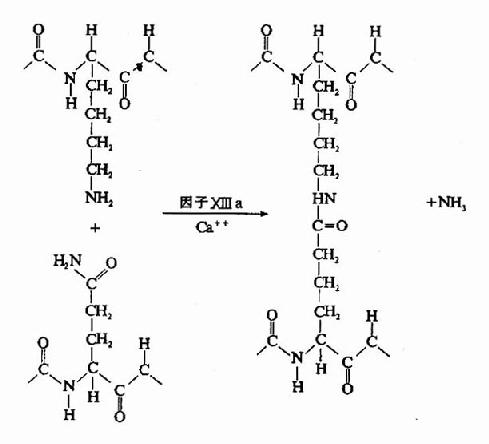
图10-10 因子XⅢa作用机理
总结上述凝血过程可归纳出以下特点:
1.凝血因子的活化本质上为蛋白质的有限水解,而许多凝血因了本身既是蛋白酶,又是酶作用的底物。这些本质为蛋白酶的凝血因子(Ⅱ、Ⅵ、Ⅺ、Ⅹ、Ⅻ)的氨基酸顺序很相似,与许多丝氨酸蛋白酶同源;活性中心的丝氨酸残基参与肽键的水解。C-端约250个氨基酸残基同源性很高,是具有催化活性的结构域。而N端的氨基酸序列变化较大,决定各凝血因子作用底物的专一性。它们催化的反应需Ca++和磷脂参加。
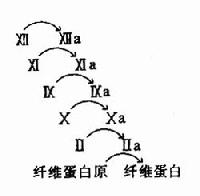
图10-11 血液凝固的瀑布效应
2.磷脂胶粒(内源性途径由血小板,外源性途径由组织凝血活素提供)使活化反应在胶粒表面进行,大大提高反应速度,而Ca++的作用在于促进酶和底物与磷脂表面的结合。
3.凝血因子活化呈瀑布效应(cascade)使血液凝固具有高效率和精密调控的特征。如图10-11所示。
4.维生素K在内、外源性凝血中均有重要作用。
5.凝血过程中的正反馈使反应不断加速,但终产物纤维蛋白有抗凝血作用。机体内凝血与抗凝血是密切联系的。