镍
镍是一种化学元素,化学符号为Ni,原子序数为28。它是一种有光泽的银白色金属,其银白色带一点淡金色。镍属于过渡金属,质硬,具延展性。纯镍的化学活性相当高,这种活性可以在反应表面积最大化的粉末状态下看到,但大块的镍金属与周围的空气反应缓慢,因为其表面已形成了一层带保护性质的氧化物。即使如此,由于镍与氧之间的活性够高,所以在地球表面还是很难找到自然的金属镍。地球表面的自然镍都被封在较大的镍铁陨石里面,这是因为陨石在太空的时候接触不到氧气的缘故。在地球上,这种自然镍总会和铁结合在一起,这点反映出它们都是超新星核合成主要的最终产物。一般认为地球的地核就是由镍铁混合物所组成的[1]。
镍的使用(天然的陨镍铁合金)最早可追溯至公元前3500年。阿克塞尔·弗雷德里克·克龙斯泰特于1751年最早分离出镍,并将它界定为化学元素,尽管他最初把镍矿石误认为铜的矿物。镍的外语名字来自德国矿工传说中同名的淘气妖精(Nickel,与英语中魔鬼别称"Old Nick"相近),这是由于镍铜矿不能用炼铜的方法炼出铜来,所以被比拟成妖魔。镍最经济的主要来源为铁矿石褐铁矿,含镍量一般为1-2%。镍的其他重要矿物包括硅镁镍矿及镍黄铁矿。镍的主要生产地包括加拿大的索德柏立区(一般认为该处是陨石撞击坑)、太平洋的新喀里多尼亚及俄罗斯的诺里尔斯克。
由于镍在室温时的氧化缓慢,所以一般视为具有耐腐蚀性。历史上,因为这一点镍被用作电镀各种表面,例如金属(如铁及黄铜)、化学装置内部及某些需要保持闪亮银光的合金(例如镍银)。世界镍生产量中的约6%仍被用于抗腐蚀纯镍电镀。镍曾经是硬币的常见成份,但现时这方面已大致上被较便宜的铁所取代,尤其是因为有些人的皮肤对镍过敏。尽管如此,英国还是在皮肤科医生的反对下,于2012年开始再使用镍铸造钱币[2]。
只有四种元素在室温时具有铁磁性,镍就是其中一种。含镍的铝镍钴合金永久磁铁,其磁力强度介乎于含铁的永久磁铁与稀土磁铁之间。镍在现代世界的的地位主要来自于它的各种合金。全世界镍产量中的约60%被用于生产各种镍钢(特别是不锈钢)。其他常见的合金,还有一些的新的高温合金,就几乎就占尽了余下的世界镍用量。用于制作化合物的化学用途只占了镍产量的不到3%[3]。作为化合物,镍在化学制造有好几种特定的用途,例如作为氢化反应的催化剂。某些微生物和植物的酶用镍作为活性位点,因此镍是它们重要的养分。
特性[编辑 | 编辑源代码]
原子及物理性质[编辑 | 编辑源代码]
镍是一种有光泽的银白色金属,其银白色带一点淡金色,可被高度磨光。只有四种元素在室温或其附近具有铁磁性,镍就是其中一种,其余三种为铁、钴及钆。其居里温度为355 °C,即大块的镍在这个温度以上就会失去磁性[4]。镍的晶胞为面心立方,晶体参数为0.352 nm,由此可得出镍的原子半径为0.124 nm。镍属于过渡金属,质硬,具延展性。
电子排布的争议[编辑 | 编辑源代码]
镍原子共有两种电子排布:[Ar] 4s2 3d8及[Ar] 4s1 3d9,而两者的能量非常接近(符号[Ar]指的是其核心结构与氩相似)。对于哪一种排布的能量较低仍存在分歧[5]。化学教科书引用的镍电子排布为[Ar] 3d8 4s2[6]或与前者相同的[Ar] 4s2 3d8[7]。这种排布遵从马德隆能量排序规则,预测4s的位置被填满后才开始填3d的位置。这一点是有实验支持的,镍原子最低的能量态为4s2 3d8能阶,更确切来说是3d8(3F) 4s2 3F的J = 4能阶[8]。
然而,这两种排布实际上都会各自衍生出一系列不同能量的态[8]。这两组能量互相交叠,而排布[Ar] 4s1 3d9的各态平均能量比[Ar] 4s2 3d8的要低。因此,原子计算的研究文献引用镍的基态排布时用的是[Ar] 4s1 3d9[5]。
同位素[编辑 | 编辑源代码]
天然镍共有五种稳定的同位素:58Ni、60Ni、61Ni、62Ni和64Ni。其中58Ni的丰度最高(68.077%)。62Ni是现存元素中每核子束缚能最高的核素,其束缚能比56Fe及56Fe还要高,而56Fe很多时候被误以为是拥有束缚能最高的原子核[9]。已被发现的镍放射性同位素共有18种,其中最稳定的三种为59Ni(半衰期76000年)、63Ni(半衰期100.1年)和56Ni(半衰期6.077天)。其他余下的放射性同位素半衰期皆少于60小时,其中大部份的半衰期更少于30秒。此元素拥有一种亚稳态[10]。
恒星“死亡”过程中的硅燃烧过程会产生镍-56,在之后的Ia型超新星爆炸时会大量放出镍-56。这些超新星在中期到后期时,其光变曲线的形状显示的正是镍-56的衰变,经电子捕获而衰变成钴-56,并最终衰变成铁-56[11]。镍-59是一种长命的宇宙源放射性同位素,其半衰期为76000年。59Ni在同位素地质学中有多种用途:它被用于鋻定陨石的着陆年份,和判定冰与沉积物中外太空尘埃的丰度。镍-60是铁-60的子体衰变产物,而铁-60是一种已绝迹的放射性核素,其半衰期为260万年。由于60Fe的半衰期是如此的长,所以如果太阳系的物质含有足够高浓度的60Fe,那么它的耐久性就很有可能会影响到60Ni的同位素构成测量结果。因此,外太空物质中的镍-60丰度,可能会为太阳系的起源及其早期历史提供线索。62Ni的每核子束缚能比其他任何元素的任何同位素都高(每核子8.7946 MeV)[12]。任何比62Ni重的同位素,都不能在不损失能量的情况下,通过核融合来进行合成。1999年发现的48Ni是已知重金属同位素的核子中质子比率最高的。镍-48含质子28个,中子20个,故具有双幻数(跟208Pb一样),因此性质异常稳定[10][13]。
在各种镍同位素的原子质量中,原子质量最轻的只有48u(48Ni),最重的则有78u(78Ni)。最近的测量结果指出,镍-78的半衰期为0.11秒;科学家们相信,镍-78这种同位素在超新星核合成过程中合成比铁重的元素时具有重要作用[14]。
产状[编辑 | 编辑源代码]
有两种含镍的合金在铁陨石中很常见:一种是锥纹石,而另一种是镍纹石。
大部份采矿得来的镍都来自两种矿床。第一种是砖红壤,主要矿物为含镍的褐铁矿:(Fe, Ni)O(OH)与硅镁镍矿(一种含镍的硅酸盐):(Ni, Mg)3Si2O5(OH)4。第二种是带磁性的硫矿床,主要矿物为镍黄铁矿:(Ni, Fe)9S8。
镍估计蕴藏量最高的地区是澳洲和新喀里多尼亚(共占45%)[16]。
就世界资源方面来说,平均含镍量达1%的已知陆上资源最少蕴含13亿公吨的镍(约为已知蕴含量的两倍)。其中六成砖红壤矿床,另外四成为硫化物矿床[16]。
根据地球物理学的证据,有假说指出地球上大部份的镍都集中在地球的外核和内核。锥纹石和镍纹石是两种天然产生的镍铁合金。铁镍在锥纹石中的比例一般在90:10与95:5之间,同时也有可能存在杂质(如钴或碳);而镍纹石的含镍量则在20%至65%之间。这两种矿物基本上都只能在镍铁陨石中找到[17]。
化合物[编辑 | 编辑源代码]
最常见的镍氧化态为+2,但Ni0、Ni+和Ni3+的化合物都有名,此外还有三种奇特的氧化态Ni2-、Ni1-和Ni4+[18]。
镍(0)[编辑 | 编辑源代码]
四羰基镍(Ni(CO)4)是由路德维希·蒙德所发现的[19]。它在室温下是一种具挥发性的液体,而且毒性猛烈。四羰基镍在加热后会分解成镍与一氧化碳。
- Ni(CO)4 模板:Eqm Ni + 4 CO
蒙德法就利用了上述这一过程来精炼镍。配合物双-(1,5环辛二烯)镍是镍氧化态也是0,由于它的配位子1,5-环辛二烯很容易就能被置换在有机镍化学中是一种很有用的催化剂。
镍(I)[编辑 | 编辑源代码]
镍(I)配合物并不常见,其中一个例子是四面体配合物NiBr(PPh3)3。此氧化态很多时候会含有Ni-Ni键,例如K4[Ni2,此化合物呈暗红色,具抗磁性,用钠汞齐还原K2[Ni2(CN)6]可得,在水中会产生氧化反应,同时会放出氢[20]。
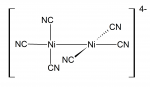
镍(II)[编辑 | 编辑源代码]
镍(II)能与所有常见的阴离子生成化合物,即硫化物、硫酸盐、碳酸盐、氢氧化物、羧酸盐及卤化物。把镍金属或其氧化物溶在硫酸里,就能大量生产出硫酸镍(II)。它有六水合物及七水合物[21],并用于镍电镀。一些常见的镍盐──如氯化物、硝酸盐及硫酸盐──溶于水后会生成一种绿色的溶液,含有水合金属配合物[Ni(H2O)6]2+。
四种常见卤素都能与镍生成化合物。这些固体的架构都是以镍为中心的八面体。其中以氯化镍(II)最为常见,其特性可作其他镍卤化物的示例。把镍金属或其氧化物溶在氢氯酸里,就能生成氯化镍(II)。一般以绿色的六水合物形式出现,化学式为NiCl2.(H2O)6。溶于水后会生成水合金属配合物[Ni(H2O)6]2+。把NiCl2.(H2O)6脱水后可得黄色的无水NiCl2。
一些镍(II)的四配位配合物(如双-(三苯基膦)氯化镍)有着两种不同的分子几何形式──四面体及平面四方。四面体配合物具顺磁性,而平面四方配合物则具抗磁性。镍配合物中的这种平面─四面体平衡,还有八面体结构,是其他较重的10族金属钯(II)与铂(II)的二价电子配合物中所没有的,因为它们基本上只有平面四方结构[18]。
二茂镍的价电子共有20个,因此性质相对地不稳定。
镍(III)及镍(IV)[编辑 | 编辑源代码]
镍(III)及镍(IV)氧化态的简单化合物只有氟化物及氧化物,而唯一例外就是KNiIO6,可算是过碘酸根离子[IO6]5-的正式盐[20]。混合氧化物BaNiO3中含有镍(IV),而氧化镍(III)中则含有镍(III),它们及镍的其他氧化物都可被用作各种蓄电池的阴极,种类包括镍镉、镍铁、氢镍(用氢气的)和镍氢(用金属氢化物的),也有一些生产商会用镍氧化物来作锂离子电池的阴极[22]。σ-予体配位子(如硫醇及磷化氢)可用于稳定镍(III)[20]。
历史[编辑 | 编辑源代码]
由于镍矿石很容易被误认为银矿石,因此对这种金属的认识和使用是相对近期的事。然而,偶然使用到镍是一件自古已有的事,可追溯至公元前3500年。从现今叙利亚境内出土的青铜含镍量可高至2%[23]。此外,中国有文献指出当地在公元前1700至1400年期间已经有使用白铜(一种铜镍合金)。英国早在17世纪就已经向中国进口这种白铜,但这种合金含镍的事实要到1822年才被发现[24]。
中世纪的德国人在厄尔斯山脉发现了一种跟铜矿石很像的红色矿物。然而,矿工们却未能从中提炼到铜,因此他们就把这种困扰归咎于他们传说中的妖精Nickel(与英语中魔鬼别称"Old Nick"相近)。他们把这种矿石命名为“铜妖”(Kupfernickel,其中Kupfer是铜的意思)[25][26][27][28]。这种矿石就是现在的红砷镍矿,它是一种镍的砷化物。1751年,阿克塞尔·弗雷德里克·克龙斯泰特男爵尝试从铜妖矿石中炼出铜来──但却炼出一种白色的金属,因此他用为矿石命名的妖精名字,来为这种金属命名[29]。用现代德语中,由于原来“铜妖”一字中的“妖”变成了镍的名字,因此原来的Kupfernickel(又作Kupfer-nickel)就另外有了镍铜的意思,所以用于称呼白铜。
镍在被发以后的唯一来源就是罕见的铜妖矿石。直至1822年,才开始从制作钴蓝色染料的副产品中取得镍。最早大规模生产镍的国家是挪威,他们自1848年开始就从本地含镍量高的磁黄铁矿生产镍。铁的生产在1889年中引入了镍,因此镍的需求量增加。新喀里多尼亚的镍矿床在1865年被发现,于1875年至1915年间为全世界提供了大部份的镍。之后发现了更多大型的镍矿床,使得真正的大规模生产镍变得可行,这些矿床为1883年发现的加拿大索德柏立盆地,1920年发现的俄罗斯诺里尔斯克-塔尔纳赫和1924年发现的南非梅伦斯基暗礁(Merensky Reef)[24]。

镍从十九世纪开始就成为了铸造硬币的材料。在美国,Nickel(镍,或其简称Nick)这个暱称原本指的是由铜及镍铸成的1美分飞鹰硬币,这种硬币在1857-58年间把纯铜的成份中的12%换成了的镍。之后1859-64年流通的印第安头像硬币也用了一样的合金成份,因此也用上了这个暱称。要注意的是在之后1865年,在镍成份提高至21%后,这个暱称就被改作称呼3美分硬币。1866年,5美分盾牌硬币名正言顺地以25%的镍含量(其余75%为铜)承继了这个暱称。时至今日,5美分硬币当年的合金比例与暱称仍然在美国通用。瑞士于1881年最早使用几乎以纯镍铸造的硬币,而当中最有名的镍币当数1922年至1981年非大战期间,由加拿大(当时世界最大的镍生产国)铸造含镍量达99.9%的5加分硬币,而高含镍量就使得这些硬币带磁性[30]。第二次世界大战期间的1942-45年,由于镍在装甲中的功用使得它成了战争资源,所以美国和加拿大都把硬币中的大部分或全部的镍成份换掉[26][31]。加拿大在韩战期间再把镍合金换成电镀钢,但到1981年才被迫停止用纯镍铸造镍币,为了把1968年后生产的纯99.9%镍合金留给价值较高的钱币。最后,到了21世纪,由于镍的价格持续上升,所以大部份曾经使用镍铸造硬币的国家都因为成本问题而放弃使用镍,而现在美国的5美分硬币是少数仍在非外层的地方用上镍的硬币。
世界生产[编辑 | 编辑源代码]
美国地质调查局的报告指出,镍最大的生产国为菲律宾、印尼、俄罗斯、加拿大及澳洲[16]。在俄罗斯以外的欧洲地区中,最大的镍矿床位于芬兰和希腊。平均含镍量达1%的已知陆上资源最少蕴含13亿公吨的镍(约为已知蕴含量的两倍)。其中六成砖红壤矿床,另外四成为硫化物矿床。此外,在大面积的海床上有含镍资源的锰壳及矿瘤,尤其是在太平洋的海床上[33]
俄勒冈州的里德尔市(Riddle)是美国唯一在本土对镍进行过商业开采的地方,当地有一个面积为几平方英里的硅镁镍矿表层矿床。该矿场于1987年关闭[34][35]。鹰矿计划打算在密歇根州的上半岛处开发一个新的镍矿场[36]。
| 原子 | ||||||||
|---|---|---|---|---|---|---|---|---|
生成缩略图出错:Unable to run external programs, proc_open() is disabled. | ||||||||
| 氦原子结构示意图。图中灰阶显示对应电子云于1s原子轨域之机率密度函数的积分强度。而原子核仅为示意,质子以粉红色、中子以紫色表示。事实上,原子核(与其中之核子的波函数)也是球型对称的。(对于更复杂的原子核则非如此) | ||||||||
| 分类 | ||||||||
| ||||||||
| 性质 | ||||||||
|
提取与精炼[编辑 | 编辑源代码]
镍金属是经由提炼冶金学的方法所提取出来。按照惯例,镍提取是经由对矿石的焙烧和还原过程而完成的,成品纯度超过75%。75%纯度的镍在不少不锈钢的应用中已经足够,不需要再精炼,但需要视乎杂质的成份。
传统上,大部份硫矿石都要经过高温冶金技巧,来造出一种硫滓,以作精炼之用。由于近来湿法冶金学的进展,所以现时不少的镍精炼都用这些方法来进行。硫矿床传统上是用泡沫浮选法按浓度处理,再经高温冶金提取金属。而在湿法冶金的过程中,镍矿石经浮选法处理后(若Ni-Fe比率太低则改用微差浮选法),就被送上熔炼。在产出硫滓以后,就用谢里特-戈登法(Sheritt-Gordon processes)处理[38]。首先,加入硫化氢将铜移除,留下只剩钴及镍的精矿。之后使用溶剂萃取法,把钴及镍分开,最终的镍成品纯度高于99.9%。
电精炼[编辑 | 编辑源代码]
第二种常见的精炼方法就是,把金属的硫滓沥取到镍的盐溶液中,然后对镍溶液使用电解冶金法,这样就能在阴极的表面上形成电解镍[38]。
蒙德法[编辑 | 编辑源代码]

要从氧化镍中取得最高纯度的镍就要用到蒙德法,它可将镍精矿的纯度提升至高于99.99%[39]。这种方法的专利由路德维希·蒙德取得,并于20世纪开始前就已经被工业生产所使用。镍在蒙德法中于40–80 °C的温度下与一氧化碳反应,生成四羰基镍。铁也会在同样的反应中生成五羰基铁,但反应速度缓慢。如有需要的话,可用蒸馏法分离。这过程中也会生成八羰基二钴,但它在反应温度下会分解成十二羰基四钴,一种不具挥发性的固体[3]。
有两种方法可以从四羰基镍中再提取镍。第一种方法,把四羰基镍在高温下传进反应室,反应室内有数万粒的镍珠,一直被持续搅拌。然后四羰基镍就会分解出纯镍,并依附到镍珠的表面上。第二种方法,把四羰基镍在230 °C的温度下传进较小的反应室,它会分解出细粉末状的纯镍。分解副产品一氧化碳在蒙德法中会被循环再用。用这方法生成的高纯度镍被称为“羰基镍”[40]。
金属价值[编辑 | 编辑源代码]
镍的市场价格于2006年至2007年初期一直大辐攀升;以2007年4月5日为准,镍的交易价格为每公吨52,300美元,或每盎司1.47美元[41]。价格在这高峰过后又大幅回落,以2013年9月19日为准,镍的交易价格则为每公吨13,788美元,或每盎司0.39美元[42]
5美分硬币含有1.25克的镍(0.04盎司),以2007年4月的价格结算,值6.5美分;再加上3.75克的铜,值3美分;所以这个硬币的金属值9美分。由于5美分硬币面值只有5美分,所以很多人想把硬币熔掉赚钱。然而,美国铸币局有见及此,已于2006年12月14日开始执行法例,并有30天公众咨询期,凡熔掉或出口1美分或5美分硬币即属违法[43]。最高判处罚款一万美元及/或入狱五年。
以2013年9月19日为准,5美分硬币(含镍及铜)熔掉后的价值为0.0450258美元,为面值的90%[44]。
应用[编辑 | 编辑源代码]
镍被用于各种特定及容易认出的工业品及消费品,其中包括不锈钢、铝镍钴磁铁、硬币、蓄电池、电吉他弦线、麦克风收音盒及多种特殊合金。特别需要强调的是,镍是一种合金金属,它的主要用途是镍钢及镍铸铁,而它们的种类繁多。镍还被广泛用于其他合金,例如镍黄铜及镍青铜,及含有各种金属元素的其他合金(如英高镍、英高合金、莫内尔合金及镍蒙克合金),而各种合金元素则包括铜、铬、铝、铅、钴、银及金[38]。
由于镍具有良好的抗腐蚀性,所以以前的人偶尔会用镍来代替装饰用的银。1859年开始,有些国家偶尔会把镍用作便宜的铸币原料(见上文),但到了20世纪后期硬币中的镍基本已被较便宜不锈钢(即铁)所取代,而美国硬币则是这趋势中重要的例外。
对某些贵金属而言,镍是一种极佳的合金用剂,因此镍被用于所谓的火试金法,专门探收各种铂系元素[46]。就这一点而言,镍能够从铂系元素的矿石中探收到全部六种的元素,甚至还能稍微地探收到一点金。高通量的镍矿也可能从事其他铂系元素的开采(主要是铂和钯),这类矿场的例子有俄罗斯的诺里尔斯克和加拿大的索德柏立盆地。
发泡镍及网格镍可被用于碱性燃料电池的气体扩散电极[47][48]。
镍及其合金常被用作氢化反应的催化剂。雷尼镍是一种常用的镍催化剂形式,它是一种有多孔结构的镍铝合金,但很多时候也会用其他催化剂,例如相关的“雷尼型”催化剂。 ] 镍是一种天然的磁致伸缩材料,亦即是说,在磁场下这种材料的长度会有少许改变[49]。而就镍的个案而言,长度的变化是减少的(即材料收缩),又称负磁致伸缩,辐度约为一百万分之五十。
镍也被用于烧结碳化钨或其他硬金属工业品,用量约为重量的6-12%。镍可使碳化钨带磁性,并为烧结碳化钨部件提供抗腐蚀性,不过它的硬度就比烧结用的钴要低[50]。
在生物中的用途[编辑 | 编辑源代码]
尽管到1970年代才被确认,但镍在微生物和植物的生理上有着重要的角色[51][52]。植物酶脲酶(一种促进尿素水解的酶)中就含有镍。镍铁类氢化酶除含有铁硫簇以外还含有镍。这种镍铁类氢化酶的特性就是能使氢氧化。有一种含镍的四吡咯辅酶──辅因子F430,可在甲基辅酶M还原酶中找到,该还原酶是产甲烷古菌的能量来源。其中一种的一氧去氢酶含有铁镍硫簇[53]。其他含镍的酶包括一种罕见的细菌类超氧化物歧化酶[54],和存在于细菌及几种寄生于锥体虫的真核寄生体中的乙二醛酶I[55](在如酵母菌及哺乳类等较高等生物中的这种酶所用的是二价电子的锌,Zn2+[56][57][58][59][60])。
毒性[编辑 | 编辑源代码]
美国政府为镍及其化合物设定了的最低风险量,其量为在15-364天期间吸入0.2 µg/m3[61]。一般相信硫化镍的烟雾及尘埃为致癌物质,及其他各种镍的化合物也有可能是致癌的[62][63]。四羰基镍[Ni(CO)4]是一种毒性很强的气体。金属羰基化合物的毒性取决于该金属本身的毒性,及该羧基化合物释出剧毒一氧化碳气的能力,而四羰基镍也不例外;而且四羰基镍在空气中会爆炸[64][65]。
美国规定的每天镍饮食摄取最大耐受量为1000 µg[66],而估计的平均镍摄取量为每天69-162 µg[67]。相对大量的镍(与铬)会在煮食过程中从不锈钢厨具沥取到食物中,其量与每天平均摄取量相若。例如在煮过10次后,一份蕃茄酱的含镍量就有88 µg[68][69]。
过敏体质的人可能会对镍有过敏反应,造成皮肤过敏,即皮肤炎。而汗疱疹的患者可能也会对镍过敏。镍是接触性过敏的一大来源,部份成因是作耳环用的珠宝首饰上的镀镍[70]。受镍过敏形响的耳洞一般会发红并变痒。由于这个问题,所以现时不少耳环都采用了不含镍的材料。对于会于与人体皮肤接触的产品,其最大可含镍量是由欧盟所管制的。在2002年,研究人员发现1欧元及2欧元的硬币含镍量远高于标准。相信是由电镀反应所造成的[71]。镍在2008年获美国接触性皮肤炎协会选为年度过敏原。[72]
报告指出,缺氧诱导因子(HIF-1)的镍诱导活化和缺氧诱导基因的调升,都是由细胞的抗坏血酸盐的水平低下所引致。在培养基中加入抗坏血酸盐后,细胞内的抗坏血酸盐水平增加,然后由金属诱导稳定化的HIF-1与取决于HIF-1α的基因表象都有了逆转[73][74]。
镍化合物中毒性最强的是甲基环戊二烯基镍亚硝酰(C5H5)NiNO。它是一种血红色的液体。
另见[编辑 | 编辑源代码]
参考资料[编辑 | 编辑源代码]
- ↑ Lars Stixrude; Evgeny Waserman and Ronald Cohen. Composition and temperature of Earth's inner core. Journal of Geophysical Research. American Geophysical Union. November 1997, 102 (B11): 24729–24740. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ 模板:Cite news
- ↑ 3.0 3.1 模板:Ullmann
- ↑ 模板:Cite book
- ↑ 5.0 5.1 模板:Cite book
- ↑ G.L. Miessler and D.A. Tarr, "Inorganic Chemistry" (2nd ed., Prentice–Hall 1999) p.38
- ↑ R.H. Petrucci et al “General Chemistry” (8th ed., Prentice–Hall 2002) p.950
- ↑ 8.0 8.1 NIST Atomic Spectrum Database 要看镍的原子能阶的话,请于能谱查询盒内输入"Ni I"然后按读取资料。
- ↑ Fewell, M. P.. The atomic nuclide with the highest mean binding energy. American Journal of Physics 63 (7): 653–58. . URL:http://adsabs.harvard.edu/abs/1995AmJPh..63..653F. Accessed: 2011-03-22. (Archived by WebCite® at http://www.webcitation.org/5xNHry2gq)
- ↑ 10.0 10.1 Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A.H.. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A. Atomic Mass Data Center. 2003, 729: 3–128. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ 模板:Cite book
- ↑ The Most Tightly Bound Nuclei [2008-11-19].
- ↑ W, P. Twice-magic metal makes its debut – isotope of nickel. Science News. October 23, 1999 [2006-09-29].
- ↑ Castelvecchi, Davide. Atom Smashers Shed Light on Supernovae, Big Bang. 2005-04-22 [2008-11-19].
- ↑ National Pollutant Inventory – Nickel and compounds Fact Sheet. Npi.gov.au. Retrieved on 2012-01-09.
- ↑ 16.0 16.1 16.2 16.3 Kuck, Peter H.. Mineral Commodity Summaries 2012: Nickel. United States Geological Survey [2008-11-19].
- ↑ Rasmussen, K. L.; Malvin, D. J.; Wasson, J. T.. Trace element partitioning between taenite and kamacite – Relationship to the cooling rates of iron meteorites. Meteoritics. 1988, 23 (2): a107–112. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ 18.0 18.1 模板:Greenwood&Earnshaw2nd
- ↑ The Extraction of Nickel from its Ores by the Mond Process. Nature. 1898, 59 (1516): 63. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ 20.0 20.1 20.2 20.3 模板:Housecroft3rd
- ↑ Keith Lascelles, Lindsay G. Morgan, David Nicholls, Detmar Beyersmann “Nickel Compounds” in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. 模板:DOI
- ↑ 模板:Cite news
- ↑ 模板:Cite book
- ↑ 24.0 24.1 模板:Cite book
- ↑ Chambers Twentieth Century Dictionary, p888, W&R Chambers Ltd, 1977.
- ↑ 26.0 26.1 Baldwin, W. H.. The story of Nickel. I. How "Old Nick's" gnomes were outwitted. Journal of Chemical Education. 1931, 8 (9): 1749. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ Baldwin, W. H.. The story of Nickel. II. Nickel comes of age. Journal of Chemical Education. 1931, 8 (10): 1954. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ Baldwin, W. H.. The story of Nickel. III. Ore, matte, and metal. Journal of Chemical Education. 1931, 8 (12): 2325. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ Weeks, Mary Elvira. The discovery of the elements: III. Some eighteenth-century metals. Journal of Chemical Education. 1932, 9: 22. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ Industrious, enduring–the 5-cent coin. Royal Canadian Mint [2009-01-10].
- ↑ Molloy, Bill. Trends of Nickel in Coins – Past, Present and Future. The Nickel Institute. 2001-11-08 [2008-11-19] (原始内容存档於2006-09-29). Canada used nickel plating on its five-cent coins in 1945
- ↑ U.S. Geological Survey
- ↑ 引用错误:无效
<ref>标签;未给name属性为usgs1的引用提供文字 - ↑ The Nickel Mountain Project. Ore Bin. 1953, 15 (10): 59–66.
- ↑ Environment Writer: Nickel. National Safety Council [2009-01-10].
- ↑ 模板:Cite news
- ↑ Matthew Champion, "Re: How many atoms make up the universe?", 1998
- ↑ 38.0 38.1 38.2 模板:Cite book
- ↑ Mond, L.; Langer, K.; Quincke, F.. Action of carbon monoxide on nickel. Journal of the Chemical Society. 1890, 57: 749–753. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ 模板:Cite book
- ↑ LME nickel price graphs. London Metal Exchange [2009-06-06].
- ↑ Nickel Prices and Nickel Price Charts
- ↑ United States Mint Moves to Limit Exportation & Melting of Coins, The United States Mint, press release, December 14, 2006
- ↑ United States Circulating Coinage Intrinsic Value Table. Coininflation.com [2013-09-13].
- ↑ Kuck, Peter H.. Mineral Yearbook 2006: Nickel. United States Geological Survey [2008-11-19].
- ↑ 模板:Cite book
- ↑ 模板:Cite book
- ↑ Bidault, F.; Brett, D. J. L.; Middleton, P. H.; Brandon, N. P.. A New Cathode Design for Alkaline Fuel Cells(AFCs). Imperial College London.
- ↑ UCLA – Magnetostrictive Materials Overview. Aml.seas.ucla.edu. Retrieved on 2012-01-09.
- ↑ Cheburaeva, R. F.; Chaporova, I. N.; Krasina, T. I.. Structure and properties of tungsten carbide hard alloys with an alloyed nickel binder. Soviet Powder Metallurgy and Metal Ceramics. 1992, 31 (5): 423. Error: Bad DOI specified模板:Namespace detect showall.
- ↑ 模板:Cite book
- ↑ 模板:Cite book electronic-book ISBN 978-94-007-5561-1 模板:ISSN electronic-模板:ISSN
- ↑ 模板:Cite book
- ↑ Szilagyi, R. K.; Bryngelson, P. A.; Maroney, M. J.; Hedman, B.; Hodgson, K. O.; Solomon, E. I.. S K-Edge X-ray Absorption Spectroscopic Investigation of the Ni-Containing Superoxide Dismutase Active Site: New Structural Insight into the Mechanism. Journal of the American Chemical Society. 2004, 126 (10): 3018–3019. Error: Bad DOI specified模板:Namespace detect showall. PMID 15012109.
- ↑ Greig N, Wyllie S, Vickers TJ, Fairlamb AH. Trypanothione-dependent glyoxalase I in Trypanosoma cruzi. Biochem. J.. 2006, 400 (2): 217–23. Error: Bad DOI specified模板:Namespace detect showall. PMID 16958620. PMC 1652828.
- ↑ Aronsson A-C, Marmstål E, Mannervik B. Glyoxalase I, a zinc metalloenzyme of mammals and yeast. Biochem. Biophys. Res. Comm.. 1978, 81 (4): 1235–1240.. Error: Bad DOI specified模板:Namespace detect showall. PMID 352355.
- ↑ Ridderström M, Mannervik B. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC1217073/ Optimized heterologous expression of the human zinc enzyme glyoxalase I]. Biochem. J.. 1996, 314 (Pt 2): 463–467. PMID 8670058. PMC 1217073.
- ↑ Saint-Jean AP, Phillips KR, Creighton DJ, Stone MJ. Unknown title. Biochemistry. 1998, 37 (29): 10345–10353. Error: Bad DOI specified模板:Namespace detect showall. PMID 9671502.
- ↑ Thornalley, P. J.. Glyoxalase I-structure, function and a critical role in the enzymatic defence against glycation. Biochemical Society Transactions. 2003, 31 (Pt 6): 1343–1348. Error: Bad DOI specified模板:Namespace detect showall. PMID 14641060.
- ↑ 模板:Cite book
- ↑ ToxGuideTM for Nickel. U.S. Department of Health and Human Services. Agency for Toxic Substances and Disease Registry
- ↑ Kasprzak; Sunderman Jr, F. W.; Salnikow, K.. Nickel carcinogenesis. Mutation research. 2003, 533 (1–2): 67–97. Error: Bad DOI specified模板:Namespace detect showall. PMID 14643413.
- ↑ Dunnick, JK; Elwell, M. R.; Radovsky, A. E.; Benson, J. M.; Hahn, F. F.; Nikula, K. J.; Barr, E. B.; Hobbs, C. H.. Comparative carcinogenic effects of nickel subsulfide, nickel oxide, or nickel sulfate hexahydrate chronic exposures in the lung. Cancer Research. 1995, 55 (22): 5251–6. PMID 7585584.
- ↑ 模板:Cite book
- ↑ Barceloux, Donald G.; Barceloux, Donald. Nickel. Clinical Toxicology. 1999, 37 (2): 239–258. Error: Bad DOI specified模板:Namespace detect showall. PMID 10382559.
- ↑ Trumbo P, Yates AA, Schlicker S, Poos M. Dietary reference intakes: vitamin A, vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. J Am Diet Assoc. Mar 2001, 101 (3): 294–301. Error: Bad DOI specified模板:Namespace detect showall. PMID 11269606.
- ↑ 模板:Cite book
- ↑ Kamerud KL, Hobbie KA, Anderson KA. Stainless Steel Leaches Nickel and Chromium into Foods During Cooking. J Agric Food Chem. Aug 28, 2013. Error: Bad DOI specified模板:Namespace detect showall. PMID 23984718.
- ↑ Flint GN, Packirisamy S. Purity of food cooked in stainless steel utensils. Food Addit Contam. Feb–Mar 1997, 14 (2): 115–26. Error: Bad DOI specified模板:Namespace detect showall. PMID 9102344.
- ↑ Thyssen J. P., Linneberg A., Menné T., Johansen J. D.. The epidemiology of contact allergy in the general population-prevalence and main findings. Contact Dermatitis. 2007, 57 (5): 287–99. Error: Bad DOI specified模板:Namespace detect showall. PMID 17937743.
- ↑ Nestle, O.; Speidel, H.; Speidel, M. O.. High nickel release from 1- and 2-euro coins. Nature. 2002, 419 (6903): 132. Error: Bad DOI specified模板:Namespace detect showall. PMID 12226655.
- ↑ Nickel Named 2008 Contact Allergen of the Year [2009-06-06].
- ↑ Salnikow, k.; Donald, S. P.; Bruick, R. K.; Zhitkovich, A.; Phang, J. M.; Kasprzak, K. S.. Depletion of intracellular ascorbate by the carcinogenic metal nickel and cobalt results in the induction of hypoxic stress. J. Biol. Chem.. 40337–40344, 279 (39): 40337–44. Error: Bad DOI specified模板:Namespace detect showall. PMID 15271983.
- ↑ Das, K. K.; Das, S. N.; Dhundasi, S. A.. Nickel, its adverse health effects and oxidative stress (PDF). Indian J. Med. Res.. 2008, 128 (4): 117–131 [22 August 2011]. PMID 19106437.





